Amoniakas -N.H. 3
Amoniakas (europiečių kalbomis jo pavadinimas skamba kaip „amoniakas“) gavo savo pavadinimą Amono oazei Šiaurės Afrikoje, esančiai karavanų kelių sankryžoje. Karštame klimate karbamidas (NH 2) 2 CO, esantis gyvūninės kilmės atliekose, ypač greitai suyra. Vienas iš skilimo produktų yra amoniakas. Remiantis kitais šaltiniais, amoniakas gavo savo pavadinimą iš senovės egiptiečių žodžio Amonianas. Taip buvo vadinami žmonės, kurie garbino dievą Amoną. Per savo ritualus jie uostė amoniaką NH 4 Cl, kuris kaitinant išgarina amoniaką.
1. Molekulių sandara


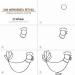
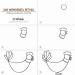
Amoniako molekulė yra trigonės piramidės formos, kurios viršūnėje yra azoto atomas. Trys nesuporuoti azoto atomo p-elektronai dalyvauja formuojant polinius kovalentinius ryšius su trijų vandenilio atomų 1s-elektronais (N−H ryšiai), ketvirtoji išorinių elektronų pora yra vieniša, gali sudaryti donoro-akceptoriaus ryšį su vandenilio jonu, sudarydamas amonio joną NH 4 + .
Cheminio ryšio tipas:kovalentinis polinis, trys vienviečiaiσ - sigma N-H jungtys
2. Fizinės amoniako savybės
Normaliomis sąlygomis tai yra bespalvės dujos, turinčios aštrų būdingą kvapą (amoniako kvapą), beveik dvigubai lengvesnės už orą ir nuodingos.Pagal savo fiziologinį poveikį organizmui jis priklauso asfiksijos ir neurotropinio poveikio medžiagų grupei, kurios įkvėptos gali sukelti toksinę plaučių edemą ir stiprius nervų sistemos pažeidimus. Amoniako garai stipriai dirgina akių ir kvėpavimo organų gleivinę bei odą. Tai mes suvokiame kaip aštrų kvapą. Amoniako garai sukelia gausų ašarojimą, akių skausmą, cheminius junginės ir ragenos nudegimus, regėjimo praradimą, kosulio priepuolius, odos paraudimą ir niežėjimą. NH 3 tirpumas vandenyje yra itin didelis – apie 1200 tūrių (esant 0 °C) arba 700 tūrių (esant 20 °C) vienam tūriui vandens.
3.
|
Laboratorijoje |
Pramonėje |
|
Norint gauti amoniaką laboratorijoje, naudojamas stiprių šarmų poveikis amonio druskoms: NH 4 Cl + NaOH = NH 3 + NaCl + H 2 O (NH 4) 2 SO 4 + Ca(OH) 2 = 2NH3 + CaSO 4 + 2H 2 O Dėmesio!Amonio hidroksidas yra nestabili bazė, suyra: NH 4 OH ↔ NH 3 + H 2 O Priimdami amoniaką, imtuvo vamzdelį laikykite apačia į viršų, nes amoniakas yra lengvesnis už orą: |
Pramoninis amoniako gamybos metodas pagrįstas tiesiogine vandenilio ir azoto sąveika: N 2 (g) + 3H 2 (g) ↔ 2NH 3 (g) + 45,9 k J Sąlygos: katalizatorius – akyta geležis temperatūra – 450 – 500 ˚С slėgis – 25 – 30 MPa Tai vadinamasis Habero procesas (vokiečių fizikas, sukūręs fizikinius ir cheminius metodo pagrindus). |
4. Amoniako cheminės savybės
Amoniakui būdingos šios reakcijos:
- pasikeitus azoto atomo oksidacijos būsenai (oksidacijos reakcija)
- nekeičiant azoto atomo oksidacijos būsenos (pridėjimas)
|
Reakcijos, susijusios su azoto atomo oksidacijos būsenos pasikeitimu (oksidacijos reakcijos) N -3 → N 0 → N +2 NH3 –stiprus reduktorius. |
|
su deguonimi 1. Amoniako degimas (kai kaitinama) 4 NH 3 + 3 O 2 → 2 N 2 + 6 H 2 0 2. Katalizinė amoniako oksidacija (katalizatoriusPt – Rh, temperatūra) 4NH3 + 5O2 → 4NO + 6H2O Vaizdo įrašas – eksperimentas „Amoniako oksidacija esant chromo oksidui“ |
|
su metalo oksidais 2 NH3 + 3CuO = 3Cu + N2 + 3 H2O |
|
su stipriais oksidatoriais 2 NH3 + 3 Cl 2 = N 2 + 6 HCl (kai šildomas) |
|
amoniakas yra silpnas junginys ir kaitinant suyra 2NH3 ↔ N 2 + 3H 2 |
|
Reakcijos nekeičiant azoto atomo oksidacijos būsenos (papildomas Amonio jonų susidarymas NH4+pagal donoro-akceptoriaus mechanizmą) Vaizdo įrašas – eksperimentas „Kokybinė reakcija į amoniaką“ Vaizdo įrašas – eksperimentas „Dūmai be ugnies“ Vaizdo įrašas – eksperimentas „Amoniako sąveika su koncentruotomis rūgštimis“ Vaizdo įrašas – eksperimentas „Fontanas“ Vaizdo įrašas – eksperimentas „Amoniako ištirpinimas vandenyje“ |
5. Amoniako panaudojimas
Pagal gamybos apimtis amoniakas užima vieną pirmųjų vietų; Kiekvienais metais visame pasaulyje pagaminama apie 100 milijonų tonų šio junginio. Amoniakas yra skystas arba vandeninis tirpalas - amoniako vanduo, kuriame paprastai yra 25% NH 3. Toliau naudojamas didžiulis amoniako kiekis gaminti azoto rūgštį kuri eina į trąšų gamyba ir daug kitų produktų. Amoniako vanduo taip pat naudojamas tiesiogiai kaip trąša, o kartais laukai laistomi tiesiai iš rezervuarų su skystu amoniaku. Iš amoniako gauti įvairių amonio druskų, karbamido, metenamino. Jo taip pat naudojamas kaip pigus šaltnešis pramoniniuose šaldymo įrenginiuose.
Taip pat naudojamas amoniakas sintetinių pluoštų gamybai, pavyzdžiui, nailonas ir nailonas. Lengvojoje pramonėje jis naudojamas medvilnės, vilnos ir šilko valymui ir dažymui. Naftos chemijos pramonėje amoniakas naudojamas rūgštinėms atliekoms neutralizuoti, o natūralaus kaučiuko pramonėje amoniakas padeda išsaugoti lateksą keliaujant iš plantacijos į gamyklą. Amoniakas taip pat naudojamas sodos gamyboje Solvay metodu. Plieno pramonėje amoniakas naudojamas azotavimui – paviršiaus plieno sluoksnių prisotinimui azotu, o tai žymiai padidina jo kietumą.
Gydytojai naudoja vandeninius amoniako (amoniako) tirpalus kasdienėje praktikoje: vatos tamponas, pamirkytas amoniake, išveda žmogų iš alpimo būsenos. Tokios dozės amoniakas nėra pavojingas žmonėms.
PRATIMAS
Simuliatorius Nr. 1 "Amoniako degimas"
Simuliatorius Nr. 2 „Amoniako cheminės savybės“
UŽDUOTIES UŽDUOTYS
№1. Atlikite transformacijas pagal schemą:
a) Azotas → amoniakas → azoto oksidas (II)
b) Amonio nitratas → Amoniakas → Azotas
c) Amoniakas → Amonio chloridas → Amoniakas → Amonio sulfatas
ORR, sudarykite RIO el. balansą, užpildykite jonines lygtis.Nr. 2. Parašykite keturias cheminių reakcijų, kurių metu susidaro amoniakas, lygtis.
AMONIAKAS [sutrumpintai iš graikų?μμωνιακ?ς; lotyniškai sal ammoniacus; taip vadinosi amoniakas (amonio chloridas), gautas deginant kupranugarių mėšlą Amonio oazėje Libijos dykumoje] – paprasčiausias cheminis azoto ir vandenilio junginys NH 3; kelių tonų chemijos pramonės produktas.
Savybės. NH 3 molekulė turi taisyklingos piramidės formą, kurios viršuje yra azoto atomas; N-H ryšiai yra poliniai, N-H jungties energija yra 389,4 kJ/mol. N atomas turi vienišą elektronų porą, kuri lemia amoniako gebėjimą sudaryti donoro-akceptoriaus ir vandenilio ryšius. NH 3 molekulė gali apsiversti – „apsukti iš vidaus“, perleisdama azoto atomą per piramidės pagrindo plokštumą, kurią sudaro vandenilio atomai.
Amoniakas yra bespalvės aštraus kvapo dujos; tpl -77,7°C; t virimas -33,35°C; dujinio NH 3 tankis (esant 0°C, 0,1 MPa) 0,7714 kg/m 3; amoniako susidarymo iš elementų šiluma ΔН arr -45,94 kJ/mol. Sausas amoniako mišinys su oru (15,5-28 % masės NH 3) gali sprogti. Skystas NH 3 yra bespalvis, labai laužantis skystis, geras daugelio organinių ir neorganinių junginių tirpiklis. Amoniakas lengvai tirpsta vandenyje (33,1 % masės 20°C temperatūroje), šiek tiek mažiau tirpsta alkoholyje, acetone, benzene ir chloroforme. Amoniako tirpalas vandenyje Amoniako vanduo yra bespalvis skystis, turintis amoniako kvapą; tirpalas, kuriame yra 10 % masės NH3, turi prekinį pavadinimą amoniakas. Vandeniniame tirpale amoniakas dalinai jonizuojasi į NH + 4 ir OH -, o tai lemia tirpalo šarminę reakciją (pK 9,247).
Amoniako skilimas į vandenilį ir azotą tampa pastebimas aukštesnėje nei 1200°C temperatūroje, o esant katalizatoriams (Fe, Ni) – aukštesnėje nei 400°C temperatūroje. Amoniakas yra labai reaktyvus junginys. Jam būdingos prisijungimo reakcijos, ypač protonų reakcijos, kai sąveikauja su rūgštimis. Dėl to susidaro amonio druskos, kurios daugeliu savybių yra panašios į šarminių metalų druskas. Amoniakas, Lewiso bazė, prijungia ne tik H +, bet ir kitus elektronų akceptorius, pavyzdžiui, BF 3, sudarydamas BF 3 NH3. NH 3 veikiant paprastas arba sudėtingas metalų druskas, susidaro amoniakas, pavyzdžiui, cis-. Amoniakui taip pat būdingos pakeitimo reakcijos. Šarminiai ir žemės šarminiai metalai sudaro amidus su NH3 (pavyzdžiui, NaNH 2). Kaitinant amoniako atmosferoje, daugelis metalų ir nemetalų (Zn, Cd, Fe, Cr, B, Si ir kt.) sudaro nitridus (pavyzdžiui, BN). Maždaug 1000°C temperatūroje NH3 reaguoja su anglimi, sudarydamas vandenilio cianidą HCN ir iš dalies suyra į N 2 ir H 2. Su CO 2 susidaro amonio karbamatas NH 2 COONH 4, kuris 160-200°C temperatūroje ir iki 40 MPa slėgyje skyla į vandenį ir karbamidą. Vandenilį amoniake galima pakeisti halogenais. Amoniakas dega O2 atmosferoje, sudarydamas vandenį ir N2. Kataliziškai oksiduojant amoniaką (Pt katalizatorius) susidaro NO (reakcija naudojama gaminant azoto rūgštį), o oksiduojant amoniaką, sumaišytą su metanu, susidaro HCN.
Priėmimas ir naudojimas. Gamtoje amoniakas susidaro irstant azoto turintiems junginiams. 1774 metais J. Priestley pirmą kartą surinko amoniaką gyvsidabrio vonioje, susidariusį kalkėms veikiant amonio chloridui. Seniausias pramoninis NH 3 gamybos būdas yra amoniako atskyrimas nuo išmetamųjų dujų anglies koksavimo metu.
Pagrindinis šiuolaikinis amoniako gamybos būdas yra jo sintezė iš azoto ir vandenilio, 1908 metais pasiūlyta F. Haberio. Amoniako sintezė pramonėje vyksta reakcija N 2 + ZN 2 →←2NH 3. Pusiausvyros poslinkį į dešinę palengvina slėgio padidėjimas ir temperatūros sumažėjimas. Procesas vykdomas esant maždaug 30 MPa slėgiui ir 450-500°C temperatūrai, dalyvaujant katalizatoriui – Fe, aktyvuotam oksidais K 2 O, Al 2 O 3, CaO ir kt. praeinant per katalizatoriaus masę, tik 20-25% paverčiama pradiniu dujų mišiniu; Norint visiškai konvertuoti, reikalinga pakartotinė cirkuliacija. Pagrindinė žaliava H 2 gamybai gaminant amoniaką yra natūralios degiosios dujos, apdorojamos dviejų etapų metano garų-dujų riformingo metodu.
Amoniako gamyba apima šiuos etapus: gamtinių dujų valymas iš sieros junginių kataliziniu hidrinimo būdu iki H 2 S, o vėliau amoniaką absorbuojant ZnO; gamtinių dujų riformingas garais, esant 3,8 MPa slėgiui, esant 860°C temperatūrai, naudojant Ni-Al katalizatorių vamzdinėje krosnyje (pirminis riformingas); 990-1000°C temperatūroje ir 3,3 MPa ant Ni-Al katalizatoriaus likutinio metano konvertavimas garu-oru veleno konverteryje (antrinis riformingas); šiame etape vandenilis prisodrintas azotu iš atmosferos oro, kad būtų gautas azoto ir vandenilio mišinys (tūrio santykis 1:3), tiekiamas NH 3 sintezei; CO konvertavimas į CO 2 ir H 2 pirmiausia esant 450°C ir 3,1 MPa ant Fe-Cr katalizatoriaus, tada 200-260°C ir 3,0 MPa ant Zn-Cr-Cu katalizatoriaus; H 2 gryninimas iš CO 2, absorbuojant monoetanolamino tirpalu arba karštu K 2 CO 3 tirpalu esant 2,8 MPa; H 2 ir N 2 mišinio valymas hidrinant iš likusio CO ir CO 2, dalyvaujant Ni-Al katalizatoriui 280°C temperatūroje ir 2,6 MPa; išgrynintų dujų suspaudimas (suspaudimas) iki 15-30 MPa ir amoniako sintezė ant aktyvinto geležies katalizatoriaus 400-500°C temperatūroje sintezės reaktoriuje su užpildu su radialiniu arba ašiniu dujų srautu. Pramonei tiekiamame skystame amoniake yra ne mažiau kaip 99,96 % NH 3 masės. Plieno korozijai slopinti į vamzdynu transportuojamą amoniaką pridedama iki 0,2-0,4 % H 2 O.
Amoniakas naudojamas gaminant azoto rūgštį, karbamidą, amonio druskas, ammofosą, metenaminą, sodą (naudojant amoniako metodą), kaip skystas trąšas, kaip šaltnešį ir kt. Kaip darbinė medžiaga buvo naudojamas NH 3 molekulių pluoštas. pirmajame kvantiniame generatoriuje – maseris (1954).
Amoniakas yra toksiškas. Kai ore yra 0,02 tūrio % amoniako, jis dirgina gleivines. Skystas amoniakas sukelia stiprius odos nudegimus.
Pasaulyje amoniako gamyba (skaičiuojant N) yra apie 125,7 mln. tonų per metus (2001 m.), įskaitant Rusijos Federacijoje – 11 mln. tonų per metus.
Lit.: Amoniako termofizinės savybės. M., 1978; Amoniako sintezė. M., 1982 m.
A. I. Michailičenka, L. D. Kuznecovas.
bespalvės aštraus kvapo dujos, lydymosi temperatūra 80° C, virimo temperatūra 36° C, tirpsta vandenyje, alkoholyje ir daugelyje kitų organinių tirpiklių. Sintetinamas iš azoto ir vandenilio. Gamtoje jis susidaro irstant azoto turintiems organiniams junginiams. Aitrus amoniako kvapas žmonėms buvo žinomas nuo priešistorinių laikų, nes šios dujos susidaro dideli kiekiai puvimo, skaidymosi ir sausos azoto turinčių organinių junginių, tokių kaip karbamidas ar baltymai, distiliavimo metu. Gali būti, kad ankstyvosiose Žemės evoliucijos stadijose jos atmosferoje buvo gana daug amoniako. Tačiau net ir dabar nedidelius šių dujų kiekius visada galima rasti ore ir lietaus vandenyje, nes jos nuolat susidaro irstant gyvūniniams ir augaliniams baltymams. Kai kuriose Saulės sistemos planetose situacija kitokia: astronomai mano, kad nemaža Jupiterio ir Saturno masių dalis yra kietas amoniakas.Pirmą kartą gryną amoniaką 1774 m. gavo anglų chemikas
Džozefas Priestlis. Jis kaitino amoniaką (amonio chloridą) gesintomis kalkėmis (kalcio hidroksidu). 2NH reakcija 4 Cl + Ca(OH) 2 ® NH 3 + CaCl 2 vis dar naudojamas laboratorijose, jei reikia nedidelių šių dujų kiekių; Kitas patogus būdas gauti magnio nitrido amoniako hidrolizę: Mg 3 N 2 + 6H 2 O ® 2NH3 + 3Mg(OH) 2 . Priestley surinko išsiskyrusį amoniaką virš gyvsidabrio. Jis pavadino jį „šarminiu oru“, nes vandeninis amoniako tirpalas turėjo visas šarmui būdingas savybes. 1784 m. prancūzų chemikas Claude'as Louisas Berthollet, naudodamas elektros išlydį, suskaidė amoniaką į jo elementus ir taip nustatė šių dujų sudėtį, kurios 1787 m. gavo oficialų pavadinimą „ammoniakas“ iš lotyniško pavadinimo ammonia sal ammoniac; Ši druska buvo gauta netoli dievo Amono šventyklos Egipte. Šis pavadinimas vis dar saugomas daugumoje Vakarų Europos kalbų (vokiečių amoniakas, angliškas amoniakas, prancūziškas ammoniakas); Sutrumpintą pavadinimą „amoniakas“, kurį naudojame, 1801 m. pradėjo vartoti rusų chemikas Jakovas Dmitrijevičius Zacharovas, pirmasis sukūręs Rusijos cheminės nomenklatūros sistemą.Tačiau ši istorija neabejotinai turi užnugarį. Taigi, šimtą metų prieš Priestley, jo tautietį
Robertas Boyle'asStebėjau, kaip rūko pagaliukas, pamirkytas druskos rūgštyje ir padėtas po kvapiųjų dujų srove, susidarančia deginant mėšlą. Reakcijoje NH 3 + HCl® NH4 Cl "dūmus" sukuria mažos amonio chlorido dalelės, dėl kurių buvo sukurtas linksmas eksperimentas, kuris "paneigia" posakį "nėra dūmų be ugnies". Tačiau Boyle'as vargu ar buvo pirmasis dar neatrastas amoniako tyrinėtojas. Juk jis buvo gautas anksčiau, o vandeninis amoniako ir amoniako tirpalas beveik nuo seno buvo naudojamas kaip specialus šarmas apdorojant ir dažant vilną.Iki XIX amžiaus pradžios. Amoniako vanduo iš akmens anglies jau buvo gautas dideliais kiekiais kaip šalutinis produktas gaminant apšvietimo dujas. Bet iš kur anglyse yra amoniako? Jo nėra, tačiau anglys turi daug sudėtingų organinių junginių, tarp kurių, be kitų elementų, yra azotas ir vandenilis. Stipriai kaitinant (pirolizę) anglies metu šie elementai sudaro amoniaką. XIX amžiuje dujų gamyklose, kaitinant be oro prieigos, iki 700 kg kokso ir virš 200 kg (300 m
3 ) dujiniai pirolizės produktai. Karštos dujos buvo atšaldomos ir praleidžiamos per vandenį, todėl susidaro maždaug 50 kg akmens anglių dervos ir 40 kg amoniako vandens.Tačiau tokiu būdu gauto amoniako aiškiai nepakako, todėl buvo sukurti cheminiai jo sintezės metodai, pavyzdžiui, iš kalcio cianamido: CaCN.
2 + 3H 2 O ® 2NH3 + CaCO 3 arba iš natrio cianido: NaCN + 2H 2 O ® HCOONa + NH 3 . Šie metodai ilgą laiką buvo laikomi perspektyviais, nes pradinės medžiagos buvo gautos iš turimų žaliavų.1901 m. prancūzų chemikas Henri Le Chatelier patentavo amoniako gavimo iš azoto ir vandenilio metodą, esant katalizatoriui. Tačiau pramoninis šio proceso panaudojimas dar buvo toli: tik 1913 m. pradėjo veikti pirmasis pramoninis amoniako sintezės įrenginys (
cm. GABERAS, FRITZAS). Šiuo metu amoniakas sintetinamas iš elementų ant geležies katalizatoriaus su priedais 420500 °C temperatūroje.° C ir apie 300 atm slėgis (kai kuriose gamyklose slėgis gali siekti 1000 atm).Amoniakas yra bespalvės dujos, kurios lengvai suskystėja atvėsusios iki 33,3
° C arba kambario temperatūroje padidinus slėgį iki maždaug 10 atm. Amoniakas užšąla atvėsęs iki 77,7° C. NH 3 molekulė turi trikampės piramidės formą, kurios viršuje yra azoto atomas. Tačiau skirtingai nuo piramidės, suklijuotos, pavyzdžiui, iš popieriaus, NH molekulė 3 lengvai „išsiverčia“, kaip skėtis, o kambario temperatūroje šią transformaciją atlieka didžiuliu dažniu - beveik 24 milijardus kartų per sekundę! Šis procesas vadinamas inversija; jo egzistavimą įrodo faktas, kad du vandenilio atomus pakeitus, pavyzdžiui, metilo ir etilo grupėmis, gaunamas tik vienas metiletilamino izomeras. Jei nebūtų inversijos, būtų du šios medžiagos erdviniai izomerai, kurie vienas nuo kito skirtųsi kaip objektas ir jo veidrodinis vaizdas. Didėjant pakaitų dydžiui, inversija lėtėja, o „kietų“ stambių pakaitų atveju tai tampa neįmanoma, tada gali egzistuoti optiniai izomerai; Ketvirtojo pakaito vaidmenį atlieka vienintelė azoto atomo elektronų pora. Pirmą kartą tokį amoniako darinį 1944 metais susintetino šveicarų chemikas Vladimiras Prelogas.. Vandenilio ryšiai egzistuoja tarp amoniako molekulių. Nors jie nėra tokie stiprūs kaip tarp vandens molekulių, šie ryšiai skatina stiprų trauką tarp molekulių. Todėl fizinės amoniako savybės iš esmės yra nenormalios, palyginti su kitų to paties pogrupio elementų hidridų savybėmis (PH 3, SbH 3, AsH 3 ). Taigi artimiausias amoniako analogas turi fosfino pH 3 virimo temperatūra yra 87,4° C ir lydymosi temperatūra 133,8° C, nepaisant to, kad molekulės PH 3 dvigubai sunkesnis už NH molekulę 3 . Kietajame amoniake kiekvienas azoto atomas yra sujungtas su šešiais vandenilio atomais trimis kovalentinėmis ir trimis vandenilio jungtimis. Tirpstant amoniakui nutrūksta tik 26 % visų vandenilinių jungčių, dar 7 % nutrūksta, kai skystis pašildomas iki virimo temperatūros. Ir tik virš šios temperatūros išnyksta beveik visi likę ryšiai tarp molekulių.Be kitų dujų, amoniakas išsiskiria didžiuliu tirpumu vandenyje: normaliomis sąlygomis 1 ml vandens gali sugerti daugiau nei litrą amoniako dujų (tiksliau, 1170 ml), kad susidarytų 42,8 % tirpalas. Jei skaičiuotume santykį NH
3 ir H 2 O tirpale, prisotintame normaliomis sąlygomis, paaiškėja, kad vienoje vandens molekulėje yra viena amoniako molekulė. Kai toks tirpalas stipriai atšaldomas (iki maždaug 80° C) susidaro amoniako hidrato NH kristalai 3 H 2 O Taip pat žinomas hidratas, kurio sudėtis yra 2NH 3 H 2 O. Vandeniniai amoniako tirpalai turi unikalią savybę tarp visų šarmų: jų tankis mažėja didėjant tirpalo koncentracijai (nuo 0,99 g/cm). 3 1% tirpalui iki 0,73 g/cm 3 už 70 proc. Tuo pačiu metu amoniaką gana lengva „išstumti“ iš vandeninio tirpalo: kambario temperatūroje garų slėgis virš 25% tirpalo yra du trečdaliai atmosferos slėgio, virš 4% tirpalo – 26 mm Hg. (3500 Pa) ir net ant labai praskiesto 0,4% tirpalo jis vis dar yra 3 mmHg. (400 Pa). Nenuostabu, kad net silpni vandeniniai amoniako tirpalai turi ryškų „amoniako“ kvapą, o laikomi laisvai sandariame inde gana greitai „išblunka“. Trumpas virinimas gali visiškai pašalinti amoniaką iš vandens.Gražus demonstracinis eksperimentas pagrįstas dideliu amoniako tirpumu vandenyje. Jei į apverstą kolbą su amoniaku per siaurą vamzdelį, jungiantį kolbą su indu su vandeniu, įlašinami keli vandens lašai, dujos greitai jose ištirps, slėgis kris, o veikiamas atmosferos slėgio vanduo iš indas su jame ištirpintu indikatoriumi (fenolftaleinu) su jėga veržiasi į kolbą. Ten jis iškart taps raudonas, nes susidaro šarminis tirpalas.
Amoniakas yra chemiškai gana aktyvus ir sąveikauja su daugeliu medžiagų. Gryname deguonyje jis dega šviesiai geltona liepsna, daugiausia virsdamas azotu ir vandeniu. Amoniako ir oro mišiniai, kurių kiekis yra 15–28 %, yra sprogūs. Esant katalizatoriams, reakcija su deguonimi gamina azoto oksidus. Kai amoniakas ištirpsta vandenyje, susidaro šarminis tirpalas, kartais vadinamas amonio hidroksidu. Tačiau šis pavadinimas nėra visiškai tikslus, nes NH hidratas pirmiausia susidaro tirpale
3 H 2 O, kuris vėliau iš dalies suskyla į NH jonus 4+ ir OH . Sąlygiškai NH4 Apskaičiuojant jo disociacijos laipsnį OH laikomas silpna baze, daroma prielaida, kad visas tirpale esantis amoniakas yra NH pavidalo; 4 OH, o ne kaip hidratas.Vienos elektronų poros dėka amoniakas sudaro daugybę sudėtingų junginių su metalo jonais, vadinamuosius aminų kompleksus arba amoniako junginius. Skirtingai nuo organinių aminų, šiuose kompleksuose visada yra trys vandenilio atomai, susiję su azoto atomu.
Kaip ir vandens atveju, kompleksavimą su amoniaku dažnai lydi medžiagos spalvos pasikeitimas. Taigi, balti vario sulfato milteliai, ištirpinti vandenyje, sudaro mėlyną vario sulfato tirpalą, susidarant vandens kompleksui 2+ . O įdėjus amoniako šis tirpalas įgauna intensyviai mėlynai violetinę spalvą, priklausančią 2+ amino kompleksui. . Bevandenis nikelio (II) chloridas taip pat yra aukso geltonumo spalvos, Cl 2 kristalinis hidratas žalia ir amoniakas Cl 2 šviesiai mėlynas. Daugelis amino kompleksų yra gana stabilūs ir gali būti gaunami kietoje būsenoje. Buvo naudojamas kietas amoniako ir sidabro chlorido kompleksasMichaelas Faradėjusamoniakui suskystinti. Faradėjus kaitino kompleksinę druską viename sandaraus stiklo vamzdžio vingyje, o kitame vingyje, patalpintame į aušinimo mišinį, slėgiu buvo surinktas skystas amoniakas. Amonio tiocianato (rodanido) amoniako kompleksas turi neįprastų savybių. Jei sausa druska NH 4
NCS atšaldomas iki 0°
C, padėkite į amoniako atmosferą, druska "išlydys" ir virs skysčiu, kuriame yra 45% amoniako pagal svorį. Šis skystis gali būti laikomas butelyje su šlifavimo kamščiu ir naudojamas kaip tam tikras amoniako „sandėlis“. Stiprūs vandeniliniai ryšiai sąlygoja santykinai didelę (palyginti su kitomis dujomis) amoniako garavimo šilumą 23,3 kJ/mol. Tai yra 4 kartus daugiau nei skysto azoto garavimo šiluma ir 280 kartų daugiau nei skysto helio. Todėl paprastai neįmanoma įpilti skysto helio į paprastą stiklą, jis iškart išgaruos. Galima atlikti tokį eksperimentą su skystu azotu, tačiau nemaža jo dalis išgaruos, vėsindama indą, o likęs skystis taip pat gana greitai išvirs. Todėl suskystintos dujos laboratorijose dažniausiai laikomos specialiuose Dewar induose su dvigubomis sienelėmis, tarp kurių yra vakuumas. Skystas amoniakas, skirtingai nei kitos suskystintos dujos, gali būti laikomas įprastuose chemijos induose, stiklinėse, kolbose, jis per greitai neišgaruoja. Jei supilsite jį į Dewar kolbą, jis ten bus laikomas labai ilgai. Ir dar viena patogesnė skysto amoniako savybė: kambario temperatūroje garų slėgis virš jo yra santykinai mažas, todėl ilgalaikių eksperimentų su juo metu galite dirbti su juo sandariose stiklinėse ampulėse, kurios lengvai atlaiko tokį slėgį (an bandymas atlikti panašų eksperimentą su skystu azotu ar deguonimi neišvengiamai sukeltų sprogimą). Didelė skysto amoniako garavimo šiluma leidžia šią medžiagą naudoti kaip šaltnešį įvairiuose šaldymo įrenginiuose; Skystas amoniakas išgaruodamas labai atvėsta. Namų šaldytuvuose taip pat buvo amoniako (dabar daugiausia freonų). Skystą amoniaką laikykite sandariuose induose. Išoriškai skystas amoniakas atrodo kaip vanduo. Panašumai tuo nesibaigia. Kaip ir vanduo, skystas amoniakas yra puikus tirpiklis tiek joniniams, tiek nepoliniams neorganiniams ir organiniams junginiams. Jame lengvai ištirpsta daug druskų, kurios, kaip ir vandeniniuose tirpaluose, disocijuoja į jonus. Tačiau cheminės reakcijos skystame amoniake dažnai vyksta visiškai kitaip nei vandenyje. Visų pirma, taip yra dėl to, kad tų pačių medžiagų tirpumas vandenyje ir skystame amoniake gali labai skirtis, kaip matyti iš toliau pateiktos lentelės, kurioje parodytas kai kurių medžiagų tirpumas (gramais 100 g tirpiklio). druskos vandenyje ir skystas amoniakas 20 laipsnių temperatūroje Iš įvairių medžiagų tirpalų skystame amoniake, be jokios abejonės, įdomiausi yra šarminių metalų tirpalai. Tokie sprendimai mokslininkus domina jau daugiau nei šimtą metų. Pirmą kartą natrio ir kalio tirpalai skystame amoniake buvo gauti 1864 m. Po kelerių metų buvo išsiaiškinta, kad jei amoniakui leidžiama tyliai išgaruoti, nuosėdose liks grynas metalas, kaip tai atsitinka su druskos tirpalu vandenyje. Tačiau ši analogija nėra Šarminių metalų tirpalų savybės skystame amoniake labai priklauso nuo koncentracijos. Atskiestuose tirpaluose yra metalų katijonai, o vietoj anijonų yra elektronai, kurie negali laisvai judėti, nes yra susieti su amoniako molekulėmis. Būtent šie surišti (solvatuoti) elektronai suteikia atskiestų šarminių metalų tirpalams skystame amoniake gražią mėlyną spalvą. Tokie sprendimai prastai praleidžia elektrą. Tačiau didėjant ištirpusio metalo koncentracijai, kai elektronai įgyja galimybę tirpale judėti, elektrinis laidumas padidėja itin stipriai – kartais trilijonus kartų, priartėdamas prie grynų metalų elektrinio laidumo! Praskiesti ir koncentruoti šarminių metalų tirpalai skystame amoniake labai skiriasi ir kitomis fizikinėmis savybėmis. Taigi tirpalai, kurių koncentracija didesnė nei 3 mol/l, kartais vadinami skystaisiais metalais: jie turi ryškų metalinį blizgesį su aukso-bronziniu atspalviu. Kartais net sunku patikėti, kad tai yra tos pačios medžiagos tirpalai tame pačiame tirpiklyje. O štai litis turi savotišką rekordą: jo koncentruotas tirpalas skystame amoniake yra labiausiai lydantis „metalas“, kuris užšąla tik esant 183 Kiek metalo gali ištirpti skystas amoniakas? Tai daugiausia priklauso nuo temperatūros. Virimo temperatūroje sočiame tirpale yra maždaug 15% (mol) šarminio metalo. Didėjant temperatūrai, tirpumas sparčiai didėja ir metalo lydymosi temperatūroje tampa be galo didelis. Tai reiškia, kad išlydytas šarminis metalas (pavyzdžiui, cezis, jau esant 28,3 Kitas labai įdomus faktas: praskiesti ir koncentruoti šarminių metalų tirpalai skystame amoniake nesimaišo vienas su kitu. Tai retas reiškinys vandeniniams tirpalams. Jei, pavyzdžiui, į 100 g skysto amoniako 43 °C temperatūroje įpilama 4 g natrio Pagal gamybos apimtis amoniakas užima vieną pirmųjų vietų; Kiekvienais metais visame pasaulyje pagaminama apie 100 milijonų tonų šio junginio. Amoniakas yra skystas arba kaip vandeninis amoniako vandens tirpalas, kuriame paprastai yra 25% NH Amoniakas taip pat naudojamas sintetiniams pluoštams, tokiems kaip nailonas ir nailonas, gaminti. Lengvojoje pramonėje jis naudojamas medvilnės, vilnos ir šilko valymui ir dažymui. Naftos chemijos pramonėje amoniakas naudojamas rūgštinėms atliekoms neutralizuoti, o natūralaus kaučiuko pramonėje amoniakas padeda išsaugoti lateksą keliaujant iš plantacijos į gamyklą. Amoniakas taip pat naudojamas sodos gamyboje naudojant metodą Gydytojai kasdienėje praktikoje naudoja vandeninius amoniako (amoniako) tirpalus: amoniake pamirkytas vatos tamponas išveda žmogų iš apalpimo. Tokios dozės amoniakas nėra pavojingas žmonėms. Tačiau šios dujos yra toksiškos. Laimei, žmonės ore jau jaučia amoniako kvapą. – vidutinė nedarbingumo koncentracija (ICt50) užtikrina 50 % nukentėjusiųjų nedarbingumą; – vidutinė slenkstinė koncentracija (PCt50) – sukelia pradinius pažeidimo simptomus 50 % paveiktų žmonių (g min/m3); – vidutinė mirtina dozė (LDt50), suleidus į skrandį, miršta 50 % sergančių asmenų, suleidus vieną kartą į skrandį (mg/kg). Norint įvertinti toksiškų cheminių medžiagų, turinčių odą rezorbcinį poveikį, toksiškumo laipsnį, naudojamos vidutinės mirtinos toksodozės (LDt50) ir vidutinės slenkstinės toksodozės (PDt50) vertės. Matavimo vienetai – g/žmogui, mg/asmeniui, ml/kg. Vidutinė mirtina dozė vieną kartą užtepus ant odos sukelia 50 % sergančiųjų mirtį. Fizinės ir cheminės amoniako savybės Vertinant galimą cheminių medžiagų pavojų, būtina atsižvelgti ne tik į toksines, bet ir į fizikines ir chemines savybes, apibūdinančias jų elgesį atmosferoje, žemėje ir vandenyje. Visų pirma, svarbiausias fizinis parametras, lemiantis įkvepiančių toksiškų medžiagų elgseną išmetamųjų teršalų (išsiliejimo) metu, yra didžiausia jų garų koncentracija ore. Pramoninėje toksikologijoje naudojamas indikatorius, kuriame atsižvelgiama tiek į toksines savybes, tiek į medžiagų lakumą – apsinuodijimo įkvėpus tikimybės koeficientą (CVIO). Šis koeficientas lygus maksimalios galimos medžiagos garų koncentracijos 200C temperatūroje ir jos mirtinos koncentracijos santykiui (A. 4.1 lentelė). Kai kuriomis savo savybėmis (virimo temperatūra –33 °C, kritinė temperatūra –132 °C) amoniakas panašus į chlorą. Kaip ir chlorą, amoniaką galima patogiai laikyti suskystintoje formoje. Garų slėgio - temperatūros ir akimirksniu išgaruojančio skysčio frakcijos priklausomybės adiabatiniame aproksimacijose, temperatūros amoniakui ir chlorui yra labai artimos. Tačiau amoniakas daugiausia gabenamas kaip atšaldytas skystis (sunkvežimiuose su šaldytuvais). Atkreipkite dėmesį, kad Jungtinėse Valstijose yra vamzdynai, kuriais amoniakas gabenamas visoje šalyje. Pagal gamybos apimtis amoniakas užima vieną pirmųjų vietų. Kasmet visame pasaulyje pagaminama apie 100 milijonų tonų šio junginio. Iš amoniako gaminama azoto rūgštis (HNO3), iš kurios gaminamos trąšos ir daugelis kitų produktų; azoto turinčios druskos [(NH4)2SO4, NH4NO3, NaNO3, Ca(NO3)2], karbamidas, cianido rūgštis. Amoniakas taip pat naudojamas sodos gamyboje amoniako metodu, organinėje sintezėje, vandeniniams tirpalams (amoniakui) ruošti, kurie įvairiai panaudojami chemijos pramonėje ir medicinoje. Skystas amoniakas, taip pat jo vandeniniai tirpalai, naudojami kaip skystos trąšos. Amoniakas yra geras tirpiklis daugeliui azoto turinčių junginių. Didelis amoniako kiekis naudojamas superfosfato amoniakavimui. Amoniakas išgaruoja absorbuojant didelį šilumos kiekį iš aplinkos. Todėl amoniakas taip pat naudojamas kaip pigus šaltnešis pramoniniuose šaldymo įrenginiuose. Šiuo atveju skystas amoniakas turi atitikti GOST 6221 - 90 „Techninis skystas amoniakas“ reikalavimus. Kaip šaltnešis naudojamas skystas techninis amoniakas. Vandens kiekis neturi viršyti 0,1%. Amoniakas taip pat naudojamas sintetiniams pluoštams, tokiems kaip nailonas ir nailonas, gaminti. Lengvojoje pramonėje jis naudojamas medvilnės, vilnos ir šilko valymui ir dažymui. Naftos chemijos pramonėje amoniakas naudojamas rūgštinėms atliekoms neutralizuoti, o natūralaus kaučiuko pramonėje amoniakas padeda išsaugoti lateksą keliaujant iš plantacijos į gamyklą. Plieno pramonėje amoniakas naudojamas azotavimui – paviršiaus plieno sluoksnių prisotinimui azotu, o tai žymiai padidina jo kietumą. Bendrosios sąvokos apie šaldymo įrenginius Šaldymo sistema yra dalių, kuriose yra šaltnešio ir kurios jungiasi tarpusavyje, rinkinys, sudarantis vieną uždarą šaldymo kontūrą, skirtą šaltnešiui cirkuliuoti, tiekti ir šalinti šilumą. Šaldymo agregatas – šaldymo sistemos mazgai, komponentai ir kiti komponentai bei visa jų veiklai reikalinga įranga. Absorbcinė (arba adsorbcinė) šaldymo sistema – tai sistema, kurioje dėl aušalo garavimo susidaro šaltis; Absorberis (adsorberis) sugeria šaltnešio garus, kurie vėliau išsiskiria iš jo kaitinant, padidėjus daliniam slėgiui, o po to kondensuojasi šiuo slėgiu aušinant. Šaldymo agentas (šaldymo agentas) – tai darbo terpė, naudojama šaldymo sistemoje, kuri sugeria šilumą esant žemai temperatūrai ir slėgiui, o išskiria šilumą esant aukštesnei temperatūrai ir slėgiui. Šį procesą lydi bendros darbo aplinkos būklės pasikeitimas. Aušinimo skystis yra bet koks skystis, naudojamas šilumai perduoti, nekeičiant jo agregacijos būsenos. Šaldymo agregatų techninės konstrukcijos reikalavimai 1) Šaldymo įrenginyje turi būti įtaisai, neleidžiantys skysto amoniako lašams patekti į kompresorių įsiurbimo ertmę. 2) Aušinimo skysčio garintuvo bloke turi būti įtaisas skysčio lašeliams atskirti nuo garų-skysčio amoniako mišinio ir atskirtą skystį grąžinti į garintuvą. 3) Skystajai fazei atskirti nuo judančio garų-skysčio mišinio šaldymo sistemose su tiesioginiu aušinimu, kiekvienai virimo temperatūrai numatyti cirkuliaciniai (arba apsauginiai) imtuvai, apjungiantys skysčių separatoriaus funkcijas. Šiems tikslams leidžiama numatyti atskirus skysčių separatorius, vamzdynais sujungtus su cirkuliaciniais (apsauginiais) imtuvais, kurie neapjungia skysčių separatoriaus funkcijų. 4) Cirkuliacinių imtuvų geometrinis tūris su stovu, derinantis skysčių separatoriaus funkcijas, kiekvienam virimo taškui siurblio grandinėse su apatiniu ir viršutiniu amoniako tiekimu į aušinimo įrenginius turėtų būti apskaičiuojamas pagal pateiktas formules. 5) Avariniam (remontiniam) skysto amoniako pašalinimui iš aušinimo prietaisų, aparatų, indų ir blokų, taip pat kondensato pašalinimui karštais garais atitirpinant aušinimo įrenginius, būtina įrengti drenažo imtuvą, skirtą priimti amoniaką iš daugiausiai. daug amoniako naudojantys aparatai, indas ar blokas. 6) Drenažo imtuvo geometrinis tūris turėtų būti paimtas iš jo užpildymo būklės ne daugiau kaip 80%. 7) Šaldymo agregatų linijinių imtuvų geometrinis tūris turi būti ne didesnis kaip 30% viso patalpų aušinimo įrenginių geometrinio tūrio, technologinių įrenginių amoniako dalies ir garintuvų. 8) Šaldymo mašinose su dozuotu amoniako įkrovimu linijinis imtuvas nenumatytas. Ir vandenilis. Tai dujos be spalvos, bet aštraus kvapo. Cheminę sudėtį atspindi amoniako formulė - NH3. Padidėjus slėgiui arba sumažėjus medžiagos temperatūrai, ji virsta bespalviu skysčiu. Amoniako dujos ir jo tirpalai plačiai naudojami pramonėje ir žemės ūkyje. Medicinoje naudojamas 10% amonio hidroksidas – amoniakas. Vandenilio nitrido molekulė yra piramidės formos, kurios pagrindu yra azotas, sujungtas su trimis vandenilio atomais. N-H ryšiai yra labai poliarizuoti. Azotas stipriau pritraukia jungiančią elektronų porą. Todėl neigiamas krūvis kaupiasi ant N atomų, o teigiamas – vandenilyje. Idėją apie šį procesą suteikia molekulės modelis, elektronas ir amoniakas. Vandenilio nitridas labai gerai tirpsta vandenyje (700:1 esant 20 °C). Dėl praktiškai laisvų protonų susidaro daugybė vandenilio „tiltų“, jungiančių molekules viena su kita. Struktūrinės ypatybės ir cheminis ryšys taip pat reiškia, kad amoniakas lengvai suskystėja didėjant slėgiui arba mažėjant temperatūrai (-33 °C). Terminas „amoniakas“ buvo pradėtas vartoti 1801 m., pasiūlius rusų chemikui Ya, tačiau ši medžiaga žmonijai buvo pažįstama nuo seniausių laikų. Aitrų kvapą turinčios dujos išsiskiria irstant atliekų produktams, daugeliui organinių junginių, pavyzdžiui, baltymų ir karbamido, ir skaidant amonio druskas. Chemijos istorikai mano, kad medžiaga buvo pavadinta senovės Egipto dievo Amono vardu. Šiaurės Afrikoje yra Sivos oazė (Ammona). Apsuptas senovinio miesto griuvėsių ir šventyklos, šalia kurios yra amonio chlorido telkinių. Europoje ši medžiaga buvo vadinama „Amono druska“. Sklando legenda, kad Sivos oazės gyventojai šventykloje užuodė druską. Anglų fizikas ir chemikas R. Boyle'as eksperimentuose degino mėšlą ir stebėjo baltų dūmų susidarymą virš lazdelės, pamirkytos druskos rūgštyje ir patekusios į susidarančių dujų srovę. 1774 metais kitas britų chemikas D. Priestley pakaitino amonio chloridą su gesintomis kalkėmis ir išleido dujinę medžiagą. Priestley junginį pavadino „šarminiu oru“, nes jo tirpalas parodė Boyle'o eksperimento, kuriame buvo paaiškinta amoniako sąveika su druskos rūgštimi, savybes. Balta kieta medžiaga atsiranda, kai reaguojančių medžiagų molekulės tiesiogiai liečiasi ore. Cheminę amoniako formulę 1875 m. nustatė prancūzas C. Berthollet, atlikęs medžiagos skilimo į sudedamąsias dalis, veikiant elektros iškrovai, eksperimentą. Iki šiol Priestley, Boyle ir Berthollet eksperimentai yra atkartojami laboratorijose, siekiant gauti vandenilio nitridą ir amonio chloridą. Pramoninį metodą 1901 metais sukūrė A. Le Chatelier, gavęs medžiagos sintezės iš azoto ir vandenilio metodo patentą. Vandeninis amoniako tirpalas paprastai rašomas kaip hidroksidas – NH 4 OH. Jis pasižymi silpno šarmo savybėmis: Reakcijoje tarp amoniako ir vandens pusiausvyra pasislenka pradinių medžiagų link. Iš anksto pašildytas vandenilio nitridas gerai dega deguonimi. Azotas oksiduojamas į dviatomes paprastos medžiagos N2 molekules. Reaguodamas su vario (II) oksidu amoniakas taip pat pasižymi redukuojančiomis savybėmis. Vandenilio nitridas naudojamas gaminant amonio druskas ir azoto rūgštį – vieną iš svarbiausių chemijos pramonės produktų. Amoniakas yra žaliava sodai gaminti (naudojant nitratų metodą). Pramoniniame koncentruotame tirpale vandenilio nitrido kiekis siekia 25%. Žemės ūkyje naudojamas vandeninis amoniako tirpalas. Skystųjų trąšų formulė yra NH 4 OH. Medžiaga tiesiogiai naudojama kaip trąša. Kiti būdai praturtinti dirvą azotu yra chlorido ir fosfato druskų naudojimas. Pramoninėmis sąlygomis ir žemės ūkio patalpose nerekomenduojama kartu laikyti mineralinių trąšų, turinčių amonio druskų su šarmais. Jei pakuotės vientisumas pažeidžiamas, medžiagos gali reaguoti viena su kita, sudarydamos amoniaką ir išleisti jį į patalpų orą. Toksiškas junginys neigiamai veikia žmogaus kvėpavimo sistemą ir centrinę nervų sistemą. Amoniako ir oro mišinys yra sprogus.
Todėl skystame amoniake lengvai įvyksta tokios mainų reakcijos, kurios neįsivaizduojamos vandeniniams tirpalams, pavyzdžiui, Ba(NO 3) 2 + 2AgCl ® BaCl 2 + 2AgNO 3. NH3 molekulė stiprus vandenilio jonų akceptorius, todėl skystame amoniake ištirpinus silpną (vandeninių tirpalų atveju) acto rūgštį ji visiškai disocijuos, tai yra taps labai stipria rūgštimi: CH 3 COOH + NH 3 ® NH 4 + + CH 3 COO . Skysto amoniako aplinkoje žymiai sustiprėja rūgštinės amonio druskų savybės (lyginant su vandeniniais tirpalais). Amonio jonas skystame amoniake turi daug savybių, būdingų vandenilio jonui vandeniniuose tirpaluose. Todėl skystame amoniake amonio nitratas lengvai reaguoja, pavyzdžiui, su magniu, kad išsiskirtų vandenilis, arba su natrio peroksidu: 2NH 4 NO3 + Mg® Mg(NO3)2 + 2NH3 + H2; Na 2 O 2 + 2NH 4 NO 3 ® 2NaNO 3 + H 2 O 2 + 2NH 3 . Naudojant reakcijas skystame amoniake pirmą kartą buvo išskirti magnio, kadmio ir cinko peroksidai: Zn(NO 3) 2 + 2KO 2 ® ZnO 2 + 2KNO 3 + O 2 , gaunamas grynos formos kristalinis amonio nitritas: NaNO 2 + NH 4 Cl ® NH 4 NO 2 + NaCl, buvo atlikta daug kitų neįprastų transformacijų, pavyzdžiui, 2K + 2CO® K 2 C 2 O 2 . Pastarasis junginys turi trigubą acetileno ryšį ir turi K struktūrą+ OS є CO K + . Didelis skysto amoniako afinitetas H jonams +
leidžia atlikti įspūdingą medžio „plastifikavimo“ eksperimentą. Mediena daugiausia sudaryta iš celiuliozės: ilgos polimerinės celiuliozės molekulių grandinės yra sujungtos vandeniliniais ryšiais tarp OH hidroksilo grupių (kartais vadinamų vandenilio tilteliais). Viena vandenilio jungtis gana silpna, bet kadangi celiuliozės molekulinė masė siekia 2 mln., o molekulėje yra per 10 tūkstančių monomerų vienetų (gliukozės liekanų), ilgos celiuliozės molekulės viena su kita susijungusios labai tvirtai. Skystas amoniakas lengvai suardo vandenilio tiltelius, sujungdamas vandenilio atomus į NH jonus 4
+
, ir dėl to celiuliozės molekulės įgyja savybę slysti viena kitos atžvilgiu. Jei medinis pagaliukas kuriam laikui pamerkiamas į skystą amoniaką, jį galima bet kaip sulenkti, tarsi būtų ne iš medžio, o iš aliuminio. Ore amoniakas išgaruos per kelias minutes, o vandeniliniai ryšiai vėl atsistatys, bet kitoje vietoje, o medinis pagaliukas vėl taps standus ir tuo pačiu išlaikys tą formą, kuri buvo suteikta.
Medžiaga
AgI
Ba(NO3)2
KI
NaCl
KCl
BaCl2
ZnCl2
Tirpumas vandenyje
0
9
144
36
34
36
367
Tirpumas amoniake
207
97
182
3
0,04
0
0
Leensonas I.A. 100 klausimų ir atsakymų apie chemiją
. M., AST Astrel, 2002 m
Pramoninė amoniako reikšmė ir panaudojimo sritys
Bendrosios amoniako šaldymo įrenginių projektavimo ir saugaus veikimo taisyklės
Molekulių sandara. Elektroninė amoniako formulė

vardo kilmė

Vandenilio nitrido paruošimas


Amoniako tirpalas. Formulė ir savybės

Amoniako reikšmė ir jo tirpalai